Die Wanderrouten der Leukozyten
 Professor Dr. Barbara Walzog
Professor Dr. Barbara Walzoglehrt in der Vegetativen Physiologie im Walter-Brendel-Zentrum für Experimentelle Medizin
Ihr natürlicher Lebensraum ist das Blut: Im Kreislauf zirkulieren zehn Milliarden weißer Blutkörperchen (Leukozyten), meist im Dienste des Immunsystems. Um ihre Funktion zu erfüllen, muss jede einzelne dieser Zellen wandern, im gesamten Körper, von Kopf bis Fuß. „Wir untersuchen die Wanderschaft der Leukozyten und ihre Mechanismen bis ins molekulare Detail“ sagt Prof. Barbara Walzog vom Lehrstuhl für Vegetative Physiologie im Walter-Brendel-Zentrum für Experimentelle Medizin der LMU. Die Biologin ist die Sprecherin des 2011 gegründeten Sonderforschungsbereichs 914 „Trafficking of Immune Cells in Inflammation, Development and Disease“ der Deutschen Forschungsgemeinschaft (DFG), an dem sich dutzende Wissenschaftler der LMU München und der TU München beteiligen, aber auch des Max-Planck-Instituts für Biochemie in Martinsried.
Im Knochenmark werden zunächst alle Arten der Leukozyten aus Stammzellen gebildet. Von dort aus gehen sie auf ihre erste Reise hinein in den Kreislauf „und müssen entsprechend ihrer Funktion genau definierte Routen einschlagen“, sagt Prof. Walzog. Für die winzigen Zellen ein riesiger Weg. Die dendritischen Zellen beispielsweise befinden sich in verschiedenen peripheren Geweben des Körpers. Taucht dort körperfremdes Material wie etwa Bakterien auf, nehmen die dendritischen Zellen es auf und tragen es in die Lymphknoten. Dort präsentieren sie ihre Facht den Lymphozyten, die ihrerseits nach ihrer Bildung in die Lymphknoten einwandern und kontrollieren, ob sie „ihr“ Antigen erkennen, um dann mit der Lymphe zurück ins Blut zu migrieren und ihre Überwachungsfunktion auszuüben.
Oder die neutrophilen Granulozyten, die 65 Prozent aller Leukozyten im Blut stellen. Das Faszinierende: Die nur wenige Mikrometer großen Zellen erkennen exakt, wann sie wo im Körper aus dem Kreislauf ausscheren müssen, um ins Gewebe einzuwandern. Dort braucht sie der Körper immer dann, wenn beispielsweise eine Verletzung vorliegt und diese im Zuge einer Entzündung geheilt werden muss oder wenn Krankheitserreger über die Haut oder die Atemwege in den Organismus eindringen.
„All diese Wanderrouten sind die Grundlage der Abwehr“, sagt Barbara Walzog. Die verschiedenen Arbeitsgruppen des SFB 914 analysieren die Reisewege der Leukozyten-Arten in verschiedenen Zellkultursystemen und neuerdings auch im Organismus speziell erzeugter Labormäuse. Das ist wichtig, denn nicht immer decken sich die Erkenntnisse aus Zellkulturen mit den Verhältnissen im Organismus. Das Verhalten der Leukozyten dort „untersuchen wir mit Hilfe der Intravital-Mikroskopie“, erklärt die Biologin – also der Mikroskopie an betäubten, gleichwohl lebenden Tieren. Damit können die Wissenschaftler den Leukozyten live und direkt bei der Arbeit zusehen.
„Wenn wir das jeweilige spezifische Aktivierungsmuster der wandernden Zellen genau ermitteln, bekommen wir Angriffspunkte für neue Medikamente“
Mehr noch: Die Deutsche Forschungsgemeinschaft hat eine technische Service-Plattform bewilligt, die alle beteiligten Wissenschaftler nutzen können. Ihr Herzstück ist ein so genanntes Multiphotonen-Mikroskop, das allein über eine halbe Million Euro kostet. Dieses HighTech-Gerät erzeugt mittels eines starken Laserstrahls optische Effekte und macht im intakten Gewebe Aufnahmen der verschiedenen Leukozyten-Arten in bis zu einem Millimeter Tiefe – Bereiche, die anderweitig für mikroskopische Untersuchungen unerreichbar sind.
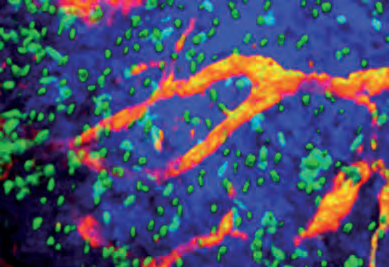
Unter anderem damit untersuchen die Wissenschaftler das Wanderungsverhalten der Leukozyten abhängig von ihrem jeweiligen Aktivierungsmuster. Das bedeutet: Wenn sich beispielsweise neutrophile Granulozyten an die Innenwand der Blutgefäße anheften, um aus dem Kreislauf auszuwandern, ist der Vorgang auf zellulärer Ebene an sich immer ähnlich. Sie rollen erst an der innersten Zellschicht (Endothel) der Gefäßwand entlang, suchen sich dann einen Ankerplatz, breiten sich aus und wandern dann zum Entzündungsort. Auf Ebene der beteiligten Signalmoleküle allerdings unterscheidet sich der Prozess – möglicherweise abhängig davon, ob die „Neutrophilen“ etwa zu einer akut entstandenen Schnittwunde im Finger eilen, um dort im Rahmen einer normalen Entzündung den entstandenen Schaden zu beseitigen oder ob sie eine krankhafte, chronische Entzündung im Zuge einer Arteriosklerose an den Gefäßwänden befeuern.
„Wenn wir das jeweilige spezifische Aktivierungsmuster der wandernden Zellen genau ermitteln, bekommen wir Angriffspunkte für neue Medikamente“, sagt Prof. Walzog. Und zwar für Medikamente, die ganz spezifisch in den betreffenden Prozess eingreifen. Das würde die Gefahr von Nebenwirkungen erheblich senken. Die Forscherin denkt an Erkrankungen wie die Rheumatoide Arthritis, bei der fehlgesteuerte Immunzellen die Strukturen der Gelenke zerstören. Oder eben an die Arteriosklerose, die Ursache von schweren Erkrankungen wie Herzinfarkt oder Schlaganfall ist.
Die Arbeitsgruppe der SFB-Sprecherin beleuchtet zur Erforschung der Arteriosklerose beispielsweise die „Beta2-Integrine“ genannten Adhäsionsmoleküle. Sofern Gewebe verletzt ist oder Bakterien eingedrungen sind, wird automatisch das Endothel der umliegenden Gefäße aktiviert. Im Zuge dessen präsentieren die Endothelzellen auf ihrer Oberfläche bestimmte, ICAM genannte Moleküle. An diesen molekularen Ankerplatz binden die Beta2-Integrine, die sich ihrerseits auf der Oberfläche der neutrophilen Granulozyten befinden. „Ob die Neutrophilen auswandern oder nicht, hängt also davon ab, ob das Endothel in dem Blutgefäß hinreichend aktiviert ist“, sagt die Forscherin.
Die Integrine leiten aber auch molekulare Signale aus der Umgebung in die Leukozyten weiter, die daraufhin ein bestimmtes, als Syk bezeichnetes Enzym aktivieren. „Syk ist für die Aktivierung vieler Funktionen der Neutrophilen zuständig“, betont die Biologin, beispielsweise kontrolliert es die Funktion des Adapterproteins Abp1, das an Elemente des Zytoskeletts bindet. Bei Mäusen, die Syk nicht mehr herstellen können, ist die Auswanderung von Neutrophilen ins Gewebe massiv gestört. Das molekulare Geflecht um Syk und Abp1 weiter zu entwirren, ist eines der vielen Teilprojekte des SFB.
Ein anderes: das seltsam anmutende Verhalten der Blutstammzellen im Knochenmark. Obwohl sie eigentlich im Knochenmark die Blutzellen bilden sollten, verlassen sie gelegentlich vorübergehend ihre „Heimat“, treten ins Blut über, dann ins Gewebe, von dort über die Lymphe wieder ins Blut, um in das Knochenmark zurückzukehren. In Fachkreisen kursiert der Verdacht, dass sich die Stammzellen auf ihrem Trip an der arteriosklerotischen Entzündung beteiligen könnten. Ob dem wirklich so ist und wie man diesen Prozess stoppen könnte – auch das wollen die LMU-Wissenschaftler klären.
Quelle: Jahresbericht 2011 (Text und Bildnachweis)

