Auf der molekularen Streckbank
24. Februar 2017
Wie das Erbgut in der Zelle verpackt ist, bestimmt auch, welche Gene aktiv sind. Münchner Forscher konnten nun mithilfe einer aus DNA konstruierten Nano-Pinzette molekulare Kräfte zwischen einzelnen Verpackungseinheiten messen.
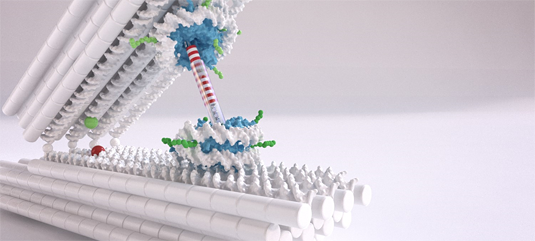 Grafik: Chris Hohmann (NIM); Dietz Lab (TUM)
Grafik: Chris Hohmann (NIM); Dietz Lab (TUM)Zwei Meter des Moleküls Desoxyribonukleinsäure (DNA), der Trägerin unserer Erbinformation, passen in jeden Kern einer menschlichen Zelle. Die DNA muss daher sorgsam verpackt werden. Sie wickelt sich dabei zunächst um bestimmte Proteine. Diese mit kleinen Spulen vergleichbaren Strukturen aus DNA und Proteinen werden als Nukleosomen bezeichnet. Die Nukleosomen sind miteinander durch Abschnitte nicht aufgewickelter DNA verbunden – unter dem Elektronenmikroskop gleicht die in Nukleosomen verpackte DNA einer Perlenkette.
Wie die Nukleosomen miteinander in Wechselwirkung stehen und welche übergeordneten Strukturen sich daraus ergeben, ist noch nicht vollständig geklärt. Ein Team von Wissenschaftlerinnen und Wissenschaftlern um Hendrik Dietz von der Technischen Universität München und Philipp Korber vom Biomedizinischen Centrum (BMC) der LMU ist es nun gelungen, einen Beitrag zur Lösung dieses Rätsels zu leisten: Zum ersten Mal konnten sie die Anziehungskräfte direkt messen, die zwischen den Nukleosomen herrschen. Ihre Ergebnisse veröffentlichten sie in den Fachmagazinen Science Advances und Nano Letters.
Nukleosomen werden in die Pinzette eingehängt
Prof. Dr. Dietz, Inhaber des Lehrstuhls Experimentelle Biophysik an der TUM, nutzt DNA als Baumaterial und konstruiert damit molekulare Strukturen; diese Technik ist unter dem Begriff DNA-Origami bekannt. Um nun die Wechselwirkungen zwischen den Nukleosomen messen zu können, entwickelten er und sein Team eine Pinzetten-Struktur, die aus zwei starren DNA-Balken besteht, die durch ein Gelenk verbunden sind. Pro Balken wurde jeweils eine Nukleosomenstruktur eingehängt. „Wir können die Position und Orientierung der Nukleosomen in den DNA-Pinzetten sehr genau einstellen.“, sagt Dietz. „Das ist wichtig, um die Interaktionen wirklich messen zu können.“
Nukleosomenstrukturen zu entwickeln, die sich in die Pinzette einhängen lassen, war die Herausforderung, der sich die Forscher an der LMU stellten. „Normalerweise gibt es beim Nukleosom zwei recht nah beieinanderliegende Enden des aufgerollten DNA-Doppelstrangs“, erklärt PD Dr. Korber, Gruppenleiter am Lehrstuhl für Molekularbiologie des BMC. „Aber was wir brauchten, waren zwei herausstehende Einzelstränge mehr in der Mitte. Das war nicht trivial, da dies die Struktur destabilisieren kann. Corinna Lieleg aus unserem Team ist es aber gelungen, die richtigen Stellen für diese Griffe zu finden.“
Die Forscher konnten so eine sehr schwache Interaktion der Nukleosomen messen, die über eine Entfernung von etwa sechs Nanometer reicht. Die Orientierungen der Nukleosomen zueinander hatten kaum Einfluss auf die Interaktion. Allerdings schwächten bestimmte chemische Veränderungen der Nukleosomen die Wechselwirkungen weiter.
Gibt es die 30-Nanometer-Faser wirklich?
Das Ergebnis könnte dazu beitragen, einen aktuellen Disput in der Wissenschaft zu klären. Die bisher gängige Theorie besagt, dass die Nukleosomen gemeinsam mit weiteren Proteinen eine Art Superspirale mit einem Durchmesser von 30 Nanometern bilden, die sogenannte 30-Nanometer-Faser. Diese nächsthöhere Strukturebene konnte aber noch nie in der lebenden Zelle beobachtet werden. Ob die DNA-Verpackung, das Chromatin, dort wirklich eine solche Superspirale annimmt, ist momentan sehr umstritten. Die geringen Kräfte zwischen den Nukleosomen, die die Forscher nun gemessen haben, sprechen eher dagegen. „Unsere Daten deuten auf sehr weiche, leicht durch äußere Einflüsse deformierbare Strukturen“, sagt Dietz.
Wie die Überstruktur der Nukleosomen aussieht, ist eine Frage von fundamentaler Bedeutung. Nur die Gene, die in einer relativ wenig kompakten Chromatinstruktur liegen, sind „aktiv“, was bedeutet, dass die dort codierten Proteine wirklich in der zelleigenen Fabrik produziert werden.
In Krebszellen gerät der Ableseprozess durcheinander
„In den vergangenen zehn Jahren ist immer deutlicher geworden, dass viele Veränderungen und Mutationen, die dazu führen, dass Zellen zu Krebszellen werden, auf dieser Ebene stattfinden“, sagt Korber. In einer Krebszelle geraten die zellulären Entscheidungen, welche Gene aktiv und welche inaktiv sind, durcheinander. Abschnitte, die nicht zugänglich sein sollten, liegen frei und umgekehrt. „Wenn aber nur die Verpackung und nicht die Gene selbst fehlerhaft sind, gibt es die therapeutische Hoffnung, dass man die Verpackung wieder ändern kann.“ Eine Heilung wäre sehr viel schwieriger, wenn die Gene selbst vollständig aus dem Genom gelöscht wären.Die Forscher wollen die molekularen Pinzetten, die sie für Messungen der Kräfte zwischen Nukleosomen verwendet haben, auch zur Untersuchung anderer Strukturen einsetzen. „In der Biologie ist es immer wichtig, welche Orientierung Strukturen zueinander haben“, sagt Korber. „Jetzt haben wir eine Art molekulare Streckbank, mit der wir gezielt die Orientierung der räumlichen Anordnung zueinander kontrollieren können.“
In einem weiteren Versuch haben die Forscher auch die Kraft gemessen, die für das Abrollen der DNA aus dem Nukleosom nötig ist. Die Forscher konnten so zeigen, dass es mithilfe des Messsystems möglich ist, sowohl Kräfte zwischen Molekülen als auch innerhalb der Moleküle zu messen. (TUM/LMU)
Titel der Originalarbeiten
Funke, Jonas J.; Ketterer, Philip; Lieleg, Corinna; Schunter, Sarah; Korber, Philipp; Dietz, Hendrik
Uncovering the forces between nucleosomes using DNA origami
Science Advances 23 Nov 2016: Vol. 2, no. 11, e1600974
Funke, Jonas J.; Ketterer, Philip; Lieleg, Corinna; Korber, Philipp; Dietz, Hendrik
Exploring Nucleosome Unwrapping Using DNA Origami
Nano Lett., 2016, 16 (12), pp 7891–7898
Quelle: Pressemitteilung LMU (Text und Bildnachweis)

