AG Zierler

Post-Doc: Dr. Katharina Jacob; Doktorand: Max Lechner; Medizindoktoranden: Kilian Hölting (FoeFoLe), Marco Fraticelli (FoeFoLe);
DoktorandInnen: Wiebke Nadolni, Sarah Hampe, Elisabeth Arlt, Valentina Vettore; Masterstudierende: Stephanie Hunger, B.Sc., Maximiliane Kronberger, B.Sc., Wiebke Nadolni, M.Sc., Jan Weber, M.Sc.; MedizindoktorandInnen: Dorothea Lewitz (FoeFoLe), Petro Bannout; Interns: Laura Fraticelli, Marco Fraticelli, Peter Stahl, Annika Schneider, B.Sc., Wiebke Nadolni, B.Sc., Jan Weber, B.Sc.; Fionán Ó Dúill, B.Sc., Tobias Klötzer, B.Sc.; Christina Moser, B.Sc., Maximiliane Kronberger, B.Sc., Moritz Pendzialek, B.Sc., Ulrike Künzel, B.Sc.; GastwissenschaftlerInnen: Lynda Addington B.Sc., Dr. Eva M. Grössinger

Ziel unserer Forschung ist es, die Bedeutung von Ionenkanälen und die Regulation von Nährstoffen, wie Kalzium (Ca2+) und Magnesium (Mg2+) in Immunzellen besser zu verstehen. Hierbei interessieren wir und für Signale in Immunzellen auf kleinster Ebene, auf der Ebene von Ionen. Dabei untersuchen wir den Transport von Ionen über die Zellmembran und zwischen den Organellen. Das Ziel unserer Forschung ist es, ein besseres Verständnis für die Bedeutung und Regulation von Ionenkanälen auf zellulärer Ebene und im Kontext von in vivo Immunreaktionen zu erlangen. Dies könnte zur Identifizierung von neuen pharmakologischen Zielstrukturen gegen entzündliche Erkrankungen, allergischen Reaktionen und Leukämien führen [1].
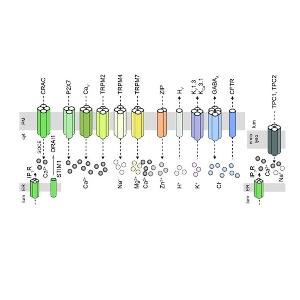
Abb. 1. Schematische Darstellung ausgewählter Ionenkanäle und Transporter auf Zellen des angeborenen und erworbenen Immunsystems. Ihr Beitrag zu gesunder und gestörter Immunität, ihre molekularen Regulatoren, und ihre Expressionsmuster in Immunzellsubtypen ist Gegenstand unserer aktuellen Forschung. CFTR—cystic fibrosis transmembrane conductance regulator, CRAC—calcium release-activated channel, cyt—cytosol, DC—dendritic cell, endo—endosome, ER—endoplasmic reticulum, GABA—gamma-amino butyric acid, IP3R—inositol-3-phosphate receptor calcium channel, lum—lumen, lyso—lysosome, PM—plasma membrane, P2X—purinergic receptor, SOCE—store operated calcium entry, STIM—stromal interaction molecule, TPC— two-pore channel, TRPM—melastatin-like transient receptor potential family, V—voltage-gated, and ZIP—Zrt/lrt-like protein. Modifiziert aus [1].
Da eine Unterbrechung dieser zellulären Signalwege zu schwerwiegenden Erkrankungen und Immundefekten führen kann, ist ein besseres Verständnis der Signalweiterleitung unumgänglich. Mit dem erworbenen Wissen wollen wir komplexe zelluläre Signale unserer Immunabwehr entschlüsseln und mögliche neue Angriffspunkte für Immuntherapien identifizieren. Wir verwenden dazu einen innovativen Ansatz aus zell- und molekularbiologischen, sowie elektrophysiologischen Methoden in verschiedenen Mausmodellen
Von besonderem Interesse ist für uns das Transiente-Rezeptor-Potential Kanalenzym, TRPM7, das einen zweiwertigen Kationenkanal mit einer enzymatischen Domäne, die für eine Serin/Threonin-Kinase kodiert, verbindet. Dieser Mg2+- und Ca2+-leitende enzymgekoppelte Ionenkanal ist in jeder eukaryotischen Zelle vorhanden und reguliert fundamentale zelluläre Vorgänge wie Wachstum, Teilung, Migration, Differenzierung und Überleben. Wird TRPM7 ausgeschaltet, führt dies zum Anhalten des Zellwachstums und schließlich zum Zelltod. Aufgrund der wichtigen Rolle des Kanals bei der Zellteilung haben wir eine Reihe von biologischen Meeresextrakten untersucht und dabei den spezifischen Blocker Waixenicin A aus einer Hawaiianischen Koralle isoliert [2]. Analoge dieses Blockers werden weiter untersucht und eine mögliche Anwendung gegen Krebszellteilung getestet.
Da Mg2+-Mangel neurodegenerative Erkrankungen, Verlust der Muskelaktivität, bestimmte Krebserkrankungen, Immundefekte, sowie allergische Reaktionen begünstigt, ist es wichtig, die Mechanismen die den Mg2+-Haushalt kontrollieren, aufzuklären. Mäuse, deren TRPM7-Enzym teilweise fehlt, entwickeln ein Krankheitsbild namens Hypomagnesiämie, bei dem der Mg2+-Haushalt gestört ist, sowie eine verstärkte allergische Kontakt-Hypersensitivitätsreaktion [3]. Wir haben daher die Rolle dieses Enzyms in der Histamin-Ausschüttung von diesen Mäusen untersucht und einen Zusammenhang zwischen dem Fehlen der Enzymaktivität und der Freisetzung von Histamin festgestellt [4].
Unsere weiteren Studien zeigen, dass die TRPM7-Kinase-Aktivität die Homöostase des Immunsystems reguliert. Kinase-defiziente Mäuse zeigen eine veränderte Zytokinexpression, sowie fehlende intra-epitheliale Lymphozyten (IELs) im Darm. Dadurch sind diese Mäuse vor der Entwicklung einer akuten Transplantat-gegen-Wirt-Reaktion (GVHD) geschützt. Außerdem ist die Differenzierung von pro-entzündlichen Th17 T-Zellen stark reduziert, wohingegen sich regulatorische T-Zellen (Tregs) normal entwickeln. In vitro gelang es uns, die molekularen Mechanismen dahinter zu entschlüsseln und SMAD2 als neues TRPM7-Kinase-Substrat zu identifizieren [5].
Erste translationale Ergebnisse deuten darauf hin, dass TRPM7 auch wichtig für die Differenzierung von humanen T-Zellen, sowie die Proliferation von chronischen Leukämiezellen, ist. TRPM7-Kanal und –Kinase stellen daher mögliche Zielstrukturen für die Behandlung von pro-entzündlichen Erkrankungen, wie Multipler Sklerose und Arthritis sowie chronischen Leukämien dar. Durch pharmakologische Modulation von TRPM7 möchten wir zur Wiederherstellung der Homöostase des Immunsystems beitragen. Hierfür wollen wir neue TRPM7-Modulatoren identifizieren.
Ein weiterer Bereich unserer Forschung beschäftigt sich mit sogenannten ‚Two-Pore-Channels‘, TPC1 und 2, welche die Ionenhomöostase der Organellen und lokale Kalziumsignale regulieren. Diese Na+ und Ca2+ leitenden Ionenkanäle spielen bei Immunzellen eine wichtige Rolle. Die Kanäle sind in verschiedenen eukaryotischen Organismen in der Biomembran von sauren Organellen wie Endosomen und Lysosomen lokalisiert. Ein Schwerpunkt unserer aktuellen Forschung ist es die Funktion dieser TPCs in Mastzellen und basophilen Granulozyten zu untersuchen. Beide Zelltypen spielen eine wichtige Rolle bei Anaphylaxie und besitzen eine regulatorische Funktion, indem sie Entzündungsmediatoren wie Histamin freisetzen.
Die Signalweiterleitung in Mastzellen wird hauptsächlich über die Ausschüttung von Ca2+ aus dem größten intrazellulärem Ca2+-Speicher dem Endoplasmatischen Retikulum (ER) aber auch anderen Speichern, wie saure Organellen, bspw. Endolysosomen, gesteuert. Für die Kommunikation zwischen diesen Organellen scheinen TPC1-Kanäle essenziell zu sein. Wir konnten zeigen, dass allergische Reaktionen und Anaphylaxie mit dem endolysosomalen TPC1-Kanal in Verbindung stehen. Genetische Deletion von Tpc1 führte zu verstärkter Anaphylaxie in vivo. Die Ausschüttung von Histamine, reguliert über intrazelluläre Ca2+-Signale, war erhöht, wenn TPC1 genetisch oder pharmakologisch inhibiert wurde. Umgekehrt soll die Stimulation der TPC Kanalaktivität durch seine endogenen Liganden, Nicotinic Adenine Dinucleotide Phosphate (NAADP) oder Phosphatidylinositol 3,5-Bisphosphate (PI(3,5)P2), dazu führen, dass durch die Ausschüttung von Ca2+ aus den Endolysosomen, die Interaktion mit dem ER gefördert und die Ca2+-Homöostase aufrechterhalten wird. Dadurch wirkte sich die Aktivität von TPC1 regulierend auf die Exozytose aus [6]. Die molekulare Interaktion zwischen diesen Organellen steht nun im Zentrum unserer Untersuchungen.

AG-Leitung / Wissenschaftliche Mitarbeiterin
| Name | Telefon | Raum | Funktion | |
|---|---|---|---|---|
| Fraticelli, Marco | marco.fraticelli@campus.lmu.de | +49 89 2180 75706 | cand. med. | |
| Jacob, Katharina | Katharina.jacob@lrz.uni-muenchen.de | +49 89 2180 75706 | Wissenschaftliche Mitarbeiterin | |
| Lechner, Max | max.lechner@lrz.uni-muenchen.de | +49 89 2180 75706 | Doktorand |
[1] Hoeger B & Zierler S; Ion channels and transporters in immunity - Where do we stand? Function (2023) doi: 10.1093/function/zqac070.
[2] Zierler S, Yao G, Zhang Z, Kuo C, Pörzgen P, Penner R, Horgan D, Fleig A; JBC, 286 (2011) doi: 10.1074/jbc.M111.264341.
[3] Ryazanova L V, Rondon L J, Zierler S, Hu Z, Galli J, Yamaguchi T P, Mazur A, Fleig A, Ryazanov A G; Nature Communications (2010). doi: 10.1038/ncomms1108.
[4] Zierler S, Sumoza-Toledo A, Suzuki S, Duill FO, Ryazanova LV, Penner R, Ryazanov AG, Fleig A TRPM7 kinase activity regulates murine mast cell degranulation; The Journal of Physiology (2016) doi: 10.1113/JP271564.
[5] Romagnani A, Vettore V, Rezzonico-Jost T, Hampe S, Rottoli E, Nadolni W, Perotti M, Meier MA, Hermanns C, Geiger S, Wennemuth G, Recordati C, Matsushita M, Muehlich S, Proietti M, Chubanov V, Gudermann T, Grassi F, Zierler S; TRPM7 kinase activity is essential for T cell colonization and alloreactivity in the gut. Nature Communications (2017) doi: 10.1038/s41467-017-01960-z.
[6] Arlt E, Fraticelli M, Tsvilovskyy V, Nadolni W, Breit A, O’Neill TJ, Resenberger S, Wennemuth G, Wahl-Schott C, Biel M, Grimm C, Freichel M, Gudermann T, Klugbauer N, Boekhoff I, Zierler S TPC1 deficiency or blockade augments systemic anaphylaxis and mast cell activity. Proc Natl Acad Sci U S A. (2020) doi: 10.1073/pnas.1920122117.
Förderungen:
2022 – 2026 DFG CRC/TRR-152 (3) P14; TR(I)Ps to Homeostasis; The kinase-coupled TRPM7-channel as regulator of immune system homeostasis
2022 – 2024 FöFoLe, LMU (Marco Fraticelli), Pharmakologische Modulation des TRPM7 Kanals mit Hilfe eines Naturstoffes
2018 – 2022 DFG CRC/TRR-152 (2) P14; TR(I)Ps to Homeostasis; The kinase-coupled TRPM7-channel as regulator of immune system homeostasis
2018 – 2020 FöFoLe, LMU (Kilian Hölting), TRPM7-Kanal und -Kinase vermittelte Signalkaskaden - von der Membran zum Kern
2014 – 2018 DFG CRC/TRR-152 (1) P14; TR(I)Ps to Homeostasis; The kinase-coupled TRPM7-channel as regulator of immune system homeostasis
2012 – 2016 Marie Curie Stiftung, FP7-PEOPLE-20112-CIG no. 322 185, REA, Brüssel, Role of enzyme-coupled TRP channels in immune cells
2012 – 2014 ERA.Net RUS, FPY ERA, FP7, STProjets-184, BMBF, Bonn, TRPM7 in regulation of T cell subsets and purinergic signaling
03/2012 FöFoLe, LMU (Dorothea Lewitz), Rolle von enzymgekoppelten Ionenkanälen bei der Aktivierung und Differenzierung von T-Zellen