AG Braun
Ionentransportmechanismen in Megakaryozyten und Blutplättchen
Ionentransportmechanismen in Megakaryozyten und Blutplättchen

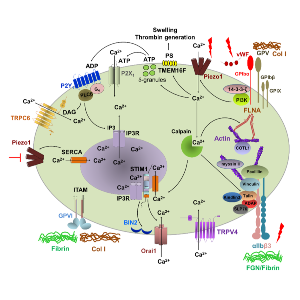
Vorgeschlagenes Modell der Mechanotransduktion in Blutplättchen
Hämodynamische Veränderungen, die durch den Blutfluss verursacht werden, führen zu einer mechanischen Belastung der Blutzellen und der Gefäßwände. Erhöhte Scherbelastung kann Thrombozyten und andere zirkulierende Zellen aktivieren und so die rasche Aktivierung von Rezeptoren, Kalziumkanälen und damit verbundenen Signalmechanismen auslösen. Scherbelastung kann auch die Faltung extrazellulärer Moleküle verändern und mechanosensitive Rezeptoren und Kalziumkanäle direkt aktivieren. Die mechanische Bewegung der extrazellulären Matrix und des intrazellulären kortikalen Aktin-Zytoskeletts kann die Konformation von Thrombozytenrezeptoren verändern und Kanalporen in der Plasmamembran öffnen. Mechanosensitive Thrombozytenrezeptoren und ihre nachgeschalteten Signalereignisse und Stoffwechselprodukte können auch indirekt Kalziumkanäle aktivieren. Während die molekulare Zusammensetzung der Mechanotransduktionswege bei Säugetieren bereits beschrieben wurde, sind die durch Scherstress induzierten Thrombozytenrezeptoren und ihr Zusammenspiel mit Kalziumkanälen noch nicht vollständig charakterisiert. Daher untersuchen wir die Rolle mechanosensitiver Thrombozytenrezeptoren und Kalziumkanäle bei der Thrombozytenaktivierung und in verschiedenen Krankheitskontexten wie der arteriellen Thrombusbildung.
Vorgeschlagenes Modell der Mechanotransduktion in Blutplättchen. Die scherungsabhängige Aktivierung des GPIbα-Rezeptors moduliert das Mechano-Signal mit PI3-Kinase an Piezo1. Mechanische Membrandehnung öffnet die Kanalpore von Piezo1 und der anschließende Ca2+-Einstrom verstärkt die Degranulation und die Calpain-Aktivitäten. Der Piezo1-vermittelte Ca2+-Einstrom stimuliert purinerge Reaktionen durch Granulatsekretion und anschließende ATP/ADP-Freisetzung und aktiviert auch die TMEM16F-vermittelte PS-Exposition. Die TMEM16F-induzierte Thrombozytenschwellung steigert die Piezo1-Aktivität weiter. Calpain spaltet Talin und andere Mitglieder des Aktin-Zytoskeletts, aktiviert dadurch αIIbβ3-Integrine und moduliert die Funktionen von Myosin II und COTL1. Calpain spaltet STIM1 und andere Komponenten des SOCE-Komplexes und reguliert dadurch die ORAI1-Aktivität. Die Aktivität von Piezo1 wird wahrscheinlich durch die Verlagerung von SERCA zur Plasmamembran während des SOCE herunterreguliert. Die Rolle von GPVI und TRPV4 bei der Mechanotransduktion von Thrombozyten ist noch nicht geklärt; sie werden wahrscheinlich durch GPIbα bzw. αIIbβ3-Integrin aktiviert.
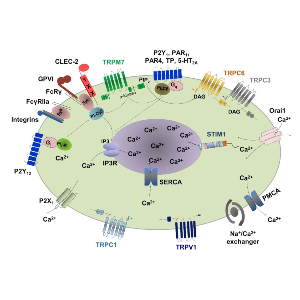
Die durch den Thrombozytenrezeptor ausgelöste Aktivierung der Phospholipase C und die anschließende Hydrolyse von PIP2 zu IP3 und DAG ist ein zentrales Ereignis zur Modulation der Ca2+-Reaktionen während der Thrombozytenaktivierung. Die Erhöhung der zytoplasmatischen Ca2+-Konzentration erfolgt durch die Freisetzung von Ca2+ aus den IP3-empfindlichen intrazellulären Ca2+-Speichern, die sich im dichten tubulären System (DTS) befinden. Die Erschöpfung der Ca2+-Speicher und die Erhöhung der DAG-Produktion induzieren den Ca2+-Eintrittsmechanismus über speichergesteuerte Ca2+-Kanäle (SOC) bzw. DAG-empfindliche rezeptorgesteuerte Ca2+-Kanäle (ROC). In den letzten zehn Jahren hat sich unsere Forschungsgruppe stark darauf konzentriert, den molekularen Mechanismus von SOCE und ROCE anhand von Blutplättchen zu verstehen, die aus genetisch veränderten Mäusen isoliert wurden. Wir identifizierten die physiologische Rolle des Ca2+-Sensors Stromal Interaction Molecule 1 (STIM1) und des Ca2+-Kanals ORAI1 als Hauptvermittler von SOCE in Blutplättchen. Unsere Ergebnisse zeigten auch, dass TRPC6 der wichtigste DAG-empfindliche ROC-Kanal in Blutplättchen ist. Unter pathophysiologischen Bedingungen konnten wir die Isoformen STIM1 und ORAI1 als wichtige Akteure bei der Bildung von arteriellen Thromben identifizieren, die in vivo zur Entstehung von Schlaganfällen beitragen. Interessanterweise erwiesen sich die Funktionen von STIM2 und ORAI2 in Blutplättchen als redundant, regulieren aber das neuronale SOCE im Mäusegehirn. Anhand von Knockout-Mausmodellen für verschiedene Kanalopathien untersuchen wir die Mechanismen des Ca2+-Eintritts und ihre Signalwege unter verschiedenen pathophysiologischen Bedingungen in vivo.
Die Rolle der Kanäle bei der Ca2+-Homöostase in Blutplättchen. Bei der Aktivierung von Blutplättchen wirken die meisten plättchenaktivierenden Rezeptoren (P2Y1, P2Y12, PAR1, PAR4, TP, 5-HT2A, GPVI, CLEC-2, P2Y12) durch die Stimulierung der Phospholipase C (PLC) β- und γ-Isoformen, die die Hydrolyse von Phosphatidyl-4,5-Bisphosphat (PIP2) zu Diacylglycerin (DAG) und Inositol-1,4,5-Trisphosphat (IP3) katalysieren. IP3 setzt Ca2+ aus den intrazellulären Speichern frei und die STIM1-Polymerisation öffnet Orai1-Kanäle in der Plasmamembran, ein Prozess, der als speichergesteuerter Ca2+-Eintrag (SOCE) bezeichnet wird. Im Gegensatz dazu wird der rezeptorgesteuerte Ca2+-Eintrag (ROCE) hauptsächlich durch ATP und DAG reguliert. Der TRPC6-Kanal ist der Hauptregulator des DAG-vermittelten ROCE. Der ATP-aktivierte P2X1 Ca2+-permeable Kanal und der Na+/Ca2+-Austauscher (NCX) tragen zum Anstieg des intrazellulären Ca2+ ([Ca2+]i) bei. Ca2+ kann durch die Ca2+-ATPasen SERCA und PMCA zurück in die Speicher oder durch die Plasmamembran an die Außenseite der Blutplättchen gepumpt werden. Thrombozyten exprimieren einen konstitutiv aktiven Mg2+- und Ca2+-durchlässigen Kanal TRPM7. Die Kinase-Domäne dieses Kanals aktiviert auch die PLC-Signalisierung und induziert SOCE in Thrombozyten.

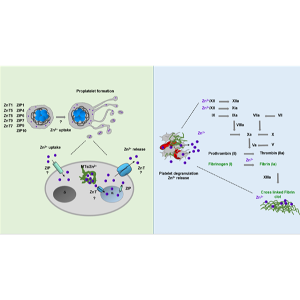
Voraussichtliche Rolle von Zintransportern in Megakaryozyten/Plättchen und bei der Bildung von Blutgerinnseln.
Obwohl seit mehr als 50 Jahren bekannt ist, dass eine verminderte Mg2+-Aufnahme häufig zu unausgewogenen Ca2+-Reaktionen in Säugetierzellen führt, sind die molekularen Akteure hinter diesem Prozess noch nicht identifiziert. Eine gestörte Mg2+-Homöostase wird bei vielen kardiovaskulären Erkrankungen beschrieben, insbesondere bei Patienten mit koronarer Herzkrankheit, Herzrhythmusstörungen, akutem Myokardinfarkt, Bluthochdruck und Schlaganfall. Wir konnten den TRPM7-Kanal als einen wichtigen Regulator der Mg2+-Homöostase in Megakaryozyten der Maus identifizieren. Eine gestörte Kanalaktivität von TRPM7 führte bei Mäusen und menschlichen Patienten zu Makrothrombozytopenie, die mit einer abnormen Myosin-IIa-Funktion und Thrombozytenproduktion einherging. Andererseits fanden wir heraus, dass die Kinase-Domäne von TRPM7 während der Thrombozytenaktivierung die Entleerung von Ca2+-Speichern moduliert und SOCE aktiviert, was darauf hindeutet, dass TRPM7 je nach dem physiologischen Zustand der Zelle sowohl die Mg2+- als auch die Ca2+-Homöostase in diesen Zellen regulieren kann. Wir untersuchen die durch TRPM7 vermittelten Signale in Megakaryozyten und Blutplättchen weiter.
Ein weiterer wichtiger Nährstoff, Zink (Zn2+), zirkuliert ebenfalls im Blutplasma, aber nur in geringen Mengen in freier Stoffwechselform, die von den Blutplättchen und anderen Blutzellen aufgenommen werden kann. Eine verringerte Zn2+-Aufnahme im Körper führt zu veränderten Thrombozytenaggregationsreaktionen und einer beeinträchtigten Hämostase, während die intrazelluläre Chelatbildung von Zn2+ in Thrombozyten Tyrosinphosphorylierungskaskaden, Thrombozytenreaktivität und Aggregationsreaktionen hemmt. Frühere Ergebnisse zeigten, dass die Inkubation von Thrombozyten mit einem Zn2+-Zusatz den intrazellulären Zn2+-Spiegel und auch die Granula erhöht, was auf die Existenz von Mechanismen der Zn2+-Aufnahme und -Speicherung hinweist, obwohl der molekulare Mechanismus des Zn2+-Transports und der Speicherung in Megakaryozyten und Thrombozyten noch unbekannt ist. Darüber hinaus wurde festgestellt, dass die Zn2+-Konzentration im Blutserum höher ist als im Plasma, was darauf hindeutet, dass aktivierte Blutplättchen während der Blutgerinnung eine erhebliche Menge an gespeichertem Zn2+ freisetzen können. Um diese Prozesse zu untersuchen, isolierten wir Blutplättchen aus Mausmodellen für Speicherpoolstörungen (SPD) und stellten eine abnorme Speicherung und Freisetzung von Zn2+ fest, die sich auch bei menschlichen SPD-Patienten bestätigte. Eine gestörte Zn2+-Freisetzung könnte sich negativ auf die Fibrinbildung auswirken. Daraus schlossen wir, dass die sekretorischen Granula, die Zn2+ speichern, zur Blutgerinnung beitragen. Wir identifizierten mehrere Zn2+-Transporter in Megakaryozyten und Thrombozyten, die an verschiedenen Signalfunktionen dieser Zelltypen beteiligt sein könnten. Unter Verwendung verschiedener Knockout- und Knockin-Zellen und Thrombozyten untersuchen wir Zn2+-abhängige pathologische Prozesse in Mäusen und Menschen.

| Name | Telefon | Raum | Funktion | |
|---|---|---|---|---|
| Klepsler, Iona | iona.klepser@campus.lmu.de | Doktorandin | ||
| Manieri, Mara | Mara.Manieri@campus.lmu.de | Doktorand |
1. Braun A, Mammadova-Bach E. GALE force in platelet production. Blood. 2023 Jan. 26;141(4):330-331.
2. Yang L, Steiger S, Shi C, Gudermann T, Mammadova-Bach E, Braun A, Anders HJ. Both hyperglycemia and hyperuricemia aggravate acute kidney injury during cholesterol embolism syndrome despite opposite effects on kidney infarct size. Kidney Int. 2023 Jul;104(1):139-150.
3. Gotru SK, Mammadova-Bach E, Sogkas G, Schuhmann MK, Schmitt K, Kraft P, Herterich S, Mamtimin M, Pinarci A, Beck S, Stritt S, Han C, Ren P, Freund JN, Klemann C, Ringshausen FC, Heemskerk JWM, Dietrich A, Nieswandt B, Stoll G, Gudermann T, Braun A. MAGT1 Deficiency Dysregulates Platelet Cation Homeostasis and Accelerates Arterial Thrombosis and Ischemic Stroke in Mice. Arterioscler Thromb Vasc Biol. 2023 Aug;43(8):1494-1509.
4. Han C, Ren P, Mamtimin M, Kruk L, Sarukhanyan E, Li C, Anders HJ, Dandekar T, Krueger I, Elvers M, Goebel S, Adler K, Münch G, Gudermann T, Braun A, Mammadova-Bach E. Minimal Collagen-Binding Epitope of Glycoprotein VI in Human and Mouse Platelets. Biomedicines. 2023 Feb 1;11(2):423.
5. Mammadova-Bach E, Gudermann T, Braun A. Platelet Mechanotransduction: Regulatory Cross Talk Between Mechanosensitive Receptors and Calcium Channels. Arterioscler Thromb Vasc Biol. 2023 Aug;43(8):1339-1348.
6. Kruk L, Braun A, Cosset E, Gudermann T, Mammadova-Bach E. Galectin functions in cancer-associated inflammation and thrombosis. Front Cardiovasc Med. 2023 Feb 17;10:1052959.
7. Kruk L, Mamtimin M, Braun A, Anders HJ, Andrassy J, Gudermann T, Mammadova-Bach E. Inflammatory Networks in Renal Cell Carcinoma. Cancers (Basel). 2023 Apr 9;15(8):2212. doi: 10.3390/cancers15082212.
8. Mamtimin M, Pinarci A, Han C, Braun A, Anders HJ, Gudermann T, Mammadova-Bach E. Extracellular DNA Traps: Origin, Function and Implications for Anti-Cancer Therapies. Front Oncol. 2022 Apr 27;12:869706.
9. Kazandzhieva K, Mammadova-Bach E, Dietrich A, Gudermann T, Braun A. TRP channel function in platelets and megakaryocytes: basic mechanisms and pathophysiological impact. Pharmacol Ther. 2022 Sep;237:108164.
10. Braun A, Anders HJ, Gudermann T, Mammadova-Bach E. Platelet-Cancer Interplay: Molecular Mechanisms and New Therapeutic Avenues. Front Oncol. 2021 Jul 12;11:665534.
11. Mammadova-Bach E, Braun A. Platelet life without TMEM163: no dense granules. Blood. 2021 Apr 1;137(13):1708-1709.
12. Balkenhol J, Kaltdorf KV, Mammadova-Bach E, Braun A, Nieswandt B, Dittrich M, Dandekar T. Comparison of the central human and mouse platelet signaling cascade by systems biological analysis. BMC Genomics. 2020 Dec 22;21(1):897.
13. Shi C, Yang L, Braun A, Anders HJ. Extracellular DNA-A Danger Signal Triggering Immunothrombosis. Front Immunol. 2020 Oct 7;11:568513.
14. Mammadova-Bach E, Jaeken J, Gudermann T, Braun A. Platelets and Defective N-Glycosylation. Int J Mol Sci. 2020 Aug 6;21(16):5630.
15. Volz J, Kusch C, Beck S, Popp M, Vögtle T, Meub M, Scheller I, Heil HS, Preu J, Schuhmann MK, Hemmen K, Premsler T, Sickmann A, Heinze KG, Stegner D, Stoll G, Braun A, Sauer M, Nieswandt B. BIN2 orchestrates platelet calcium signaling in thrombosis and thrombo-inflammation. J Clin Invest. 2020 Nov 2;130(11):6064-6079.
16. Shi C, Kim T, Steiger S, Mulay SR, Klinkhammer BM, Bäuerle T, Melica ME, Romagnani P, Möckel D, Baues M, Yang L, Brouns SLN, Heemskerk JWM, Braun A, Lammers T, Boor P, Anders HJ. Crystal Clots as Therapeutic Target in Cholesterol Crystal Embolism. Circ Res. 2020 Apr 10;126(8):e37-e52.
17. Mammadova-Bach E, Gil-Pulido J, Sarukhanyan E, Burkard P, Shityakov S, Schonhart C, Stegner D, Remer K, Nurden P, Nurden AT, Dandekar T, Nehez L, Dank M, Braun A, Mezzano D, Abrams SI, Nieswandt B. Platelet glycoprotein VI promotes metastasis through interaction with cancer cell-derived galectin-3. Blood. 2020 Apr 2;135(14):1146-1160.
18. Mammadova-Bach E, Braun A. Zinc Homeostasis in Platelet-Related Diseases. Int J Mol Sci. 2019 Oct 23;20(21):5258.
19. Scheller I, Stritt S, Beck S, Peng B, Pleines I, Heinze KG, Braun A, Otto O, Ahrends R, Sickmann A, Bender M, Nieswandt B. Coactosin-like 1 integrates signaling critical for shear-dependent thrombus formation in mouse platelets. Haematologica. 2020 Jun;105(6):1667-1676.
20. Stegner D, Hofmann S, Schuhmann MK, Kraft P, Herrmann AM, Popp S, Höhn M, Popp M, Klaus V, Post A, Kleinschnitz C, Braun A, Meuth SG, Lesch KP, Stoll G, Kraft R, Nieswandt B. Loss of Orai2 Mediated Capacitative Calcium Entry Is Neuroprotective in Acute Ischemic Stroke. Stroke. 2019 Nov;50(11):3238-3245.
21. Nagy M, van Geffen JP, Stegner D, Adams DJ, Braun A, de Witt SM, Elvers M, Geer MJ, Kuijpers MJE, Kunzelmann K, Mori J, Oury C, Pircher J, Pleines I, Poole AW, Senis YA, Verdoold R, Weber C, Nieswandt B, Heemskerk JWM, Baaten CCFMJ. Comparative Analysis of Microfluidics Thrombus Formation in Multiple Genetically Modified Mice: Link to Thrombosis and Hemostasis. Front Cardiovasc Med. 2019 Jul 30;6:99.
22. Kiran Gotru S, van Geffen JP, Nagy M, Mammadova-Bach E, Eilenberger J, Volz J, Manukjan G, Schulze H, Wagner L, Eber S, Schambeck C, Deppermann C, Brouns S, Nurden P, Greinacher A, Sachs U, Nieswandt B, Hermanns HM, Heemskerk JWM, Braun A. Defective Zinc homeostasis in mouse and human platelets with α- and δ-storage pool diseases. Sci Rep. 2019 Jun 6;9(1):8333.
23. Neidler S, Kruspig B, Hewit K, Monteverde T, Gyuraszova K, Braun A, Clark W, James D, Hedley A, Nieswandt B, Shanks E, Dick C, Murphy DJ. Identification of a Clinically Relevant Signature for Early Progression in KRAS-Driven Lung Adenocarcinoma. Cancers (Basel). 2019 Apr 29;11(5):600.
24. Mittermeier L, Demirkhanyan L, Stadlbauer B, Breit A, Recordati C, Hilgendorff A, Matsushita M, Braun A, Simmons DG, Zakharian E, Gudermann T, Chubanov V. TRPM7 is the central gatekeeper of intestinal mineral absorption essential for postnatal survival. Proc Natl Acad Sci U S A. 2019 Mar 1. 5;116(10):4706-4715. doi: 10.1073/pnas.1810633116.
25. Tseng YL, Braun A, Chang JP, Chiang ML, Tseng CY, Chen W. Micromolar concentrations of citalopram or escitalopram inhibit glycoprotein VI-mediated and integrin αIIbβ3-mediated signaling in human platelets. Toxicol Appl Pharmacol. 2019 Feb 1;364:106-113.
26. Mammadova-Bach E, Nagy M, Heemskerk JWM, Nieswandt B, Braun A. Store-operated calcium entry in thrombosis and thrombo-inflammation. Cell Calcium. 2019 Jan;77:39-48.
27. Mammadova-Bach E, Mauler M, Braun A, Duerschmied D. Autocrine and paracrine regulatory functions of platelet serotonin. Platelets. 2018 Sep;29(6):541-548.
28. Stritt S, Birkholz I, Beck S, Sorrentino S, Sapra KT, Viaud J, Heck J, Gaits-Iacovoni F, Schulze H, Du X, Hartwig JH, Braun A, Bender M, Medalia O, Nieswandt B. Profilin 1-mediated cytoskeletal rearrangements regulate integrin function in mouse platelets. Blood Adv. 2018 May 8;2(9):1040-1045.
29. Gotru SK, Gil-Pulido J, Beyersdorf N, Diefenbach A, Becker IC, Vögtle T, Remer K, Chubanov V, Gudermann T, Hermanns HM, Nieswandt B, Kerkau T, Zernecke A, Braun A. Cutting Edge: Imbalanced Cation Homeostasis in MAGT1-Deficient B Cells Dysregulates B Cell Development and Signaling in Mice. J Immunol. 2018 Apr 15;200(8):2529-2534.
30. Nagy M, Mastenbroek TG, Mattheij NJA, de Witt S, Clemetson KJ, Kirschner J, Schulz AS, Vraetz T, Speckmann C, Braun A, Cosemans JMEM, Zieger B, Heemskerk JWM. Variable impairment of platelet functions in patients with severe, genetically linked immune deficiencies. Haematologica. 2018 Mar;103(3):540-549.
31. Gotru SK, Chen W, Kraft P, Becker IC, Wolf K, Stritt S, Zierler S, Hermanns HM, Rao D, Perraud AL, Schmitz C, Zahedi RP, Noy PJ, Tomlinson MG, Dandekar T, Matsushita M, Chubanov V, Gudermann T, Stoll G, Nieswandt B, Braun A. TRPM7 Kinase Controls Calcium Responses in Arterial Thrombosis and Stroke in Mice. Arterioscler Thromb Vasc Biol. 2018 Feb;38(2):344-352.
32. Stritt S, Beck S, Becker IC, Vögtle T, Hakala M, Heinze KG, Du X, Bender M, Braun A, Lappalainen P, Nieswandt B. Twinfilin 2a regulates platelet reactivity and turnover in mice. Blood. 2017 Oct 12;130(15):1746-1756.
33. Chubanov V, Ferioli S, Wisnowsky A, Simmons DG, Leitzinger C, Einer C, Jonas W, Shymkiv Y, Bartsch H, Braun A, Akdogan B, Mittermeier L, Sytik L, Torben F, Jurinovic V, van der Vorst EP, Weber C, Yildirim ÖA, Sotlar K, Schürmann A, Zierler S, Zischka H, Ryazanov AG, Gudermann T. Epithelial magnesium transport by TRPM6 is essential for prenatal development and adult survival. Elife. 2016 2. Dec 19;5:e20914.
34. Baig AA, Haining EJ, Geuss E, Beck S, Swieringa F, Wanitchakool P, Schuhmann MK, Stegner D, Kunzelmann K, Kleinschnitz C, Heemskerk JW, Braun A, Nieswandt B. TMEM16F-Mediated Platelet Membrane Phospholipid Scrambling Is Critical for Hemostasis and Thrombosis but not Thromboinflammation in Mice-Brief Report. Arterioscler Thromb Vasc Biol. 2016 Nov;36(11):2152-2157.
35. Regn M, Laggerbauer B, Jentzsch C, Ramanujam D, Ahles A, Sichler S, Calzada- Wack J, Koenen RR, Braun A, Nieswandt B, Engelhardt S. Peptidase inhibitor 16 is a membrane-tethered regulator of chemerin processing in the myocardium. J Mol Cell Cardiol. 2016 Oct;99:57-64.
36. Stritt S, Nurden P, Favier R, Favier M, Ferioli S, Gotru SK, van Eeuwijk JM, Schulze H, Nurden AT, Lambert MP, Turro E, Burger-Stritt S, Matsushita M, Mittermeier L, Ballerini P, Zierler S, Laffan MA, Chubanov V, Gudermann T, Nieswandt B, Braun A. Defects in TRPM7 channel function deregulate thrombopoiesis through altered cellular Mg(2+) homeostasis and cytoskeletal architecture. Nat Commun. 2016 Mar 29;7:11097. doi: 10.1038/ncomms11097.
37. Wolf K, Braun A, Haining EJ, Tseng YL, Kraft P, Schuhmann MK, Gotru SK, Chen W, Hermanns HM, Stoll G, Lesch KP, Nieswandt B. Partially Defective Store Operated Calcium Entry and Hem(ITAM) Signaling in Platelets of Serotonin Transporter Deficient Mice. PLoS One. 2016 Jan 22;11(1):e0147664.
38. Mattheij NJ, Braun A, van Kruchten R, Castoldi E, Pircher J, Baaten CC, Wülling M, Kuijpers MJ, Köhler R, Poole AW, Schreiber R, Vortkamp A, Collins PW, Nieswandt B, Kunzelmann K, Cosemans JM, Heemskerk JW. Survival protein anoctamin-6 controls multiple platelet responses including phospholipid scrambling, swelling, and protein cleavage. FASEB J. 2016 Feb;30(2):727-37.
39. Hofmann S, Braun A, Pozgaj R, Morowski M, Vögtle T, Nieswandt B. Mice lacking the SLAM family member CD84 display unaltered platelet function in hemostasis and thrombosis. PLoS One. 2014 Dec 31;9(12):e115306.
40. Göbel K, Schuhmann MK, Pankratz S, Stegner D, Herrmann AM, Braun A, Breuer J, Bittner S, Ruck T, Wiendl H, Kleinschnitz C, Nieswandt B, Meuth SG. Phospholipase D1 mediates lymphocyte adhesion and migration in experimental autoimmune encephalomyelitis. Eur J Immunol. 2014 Aug;44(8):2295-305.
41. Montani L, Buerki-Thurnherr T, de Faria JP, Pereira JA, Dias NG, Fernandes R, Gonçalves AF, Braun A, Benninger Y, Böttcher RT, Costell M, Nave KA, Franklin RJ, Meijer D, Suter U, Relvas JB. Profilin 1 is required for peripheral nervous system myelination. Development. 2014 Apr;141(7):1553-61.
42. Timofeev O, Schlereth K, Wanzel M, Braun A, Nieswandt B, Pagenstecher A, Rosenwald A, Elsässer HP, Stiewe T. p53 DNA binding cooperativity is essential for apoptosis and tumor suppression in vivo. Cell Rep. 2013 May 30;3(5):1512-25.
43. Pfeiffer V, Götz R, Xiang C, Camarero G, Braun A, Zhang Y, Blum R, Heinsen H, Nieswandt B, Rapp UR. Ablation of BRaf impairs neuronal differentiation in the postnatal hippocampus and cerebellum. PLoS One. 2013;8(3):e58259.
44. Bender M, May F, Lorenz V, Thielmann I, Hagedorn I, Finney BA, Vögtle T, Remer K, Braun A, Bösl M, Watson SP, Nieswandt B. Combined in vivo depletion of glycoprotein VI and C-type lectin-like receptor 2 severely compromises hemostasis and abrogates arterial thrombosis in mice. Arterioscler Thromb Vasc Biol. 2013 May;33(5):926-34.
45. Gupta S, Braun A, Morowski M, Premsler T, Bender M, Nagy Z, Sickmann A, Hermanns HM, Bösl M, Nieswandt B. CLP36 is a negative regulator of glycoprotein VI signaling in platelets. Circ Res. 2012 Nov 9;111(11):1410-20.
46. van Kruchten R, Braun A, Feijge MA, Kuijpers MJ, Rivera-Galdos R, Kraft P, Stoll G, Kleinschnitz C, Bevers EM, Nieswandt B, Heemskerk JW. Antithrombotic potential of blockers of store-operated calcium channels in platelets. Arterioscler Thromb Vasc Biol. 2012 Jul;32(7):1717-23.
47. Nevalainen EM, Braun A, Vartiainen MK, Serlachius M, Andersson LC, Moser M, Lappalainen P. Twinfilin-2a is dispensable for mouse development. PLoS One. 2011;6(8):e22894.
48. Hulot JS, Fauconnier J, Ramanujam D, Chaanine A, Aubart F, Sassi Y, Merkle S, Cazorla O, Ouillé A, Dupuis M, Hadri L, Jeong D, Mühlstedt S, Schmitt J, Braun A, Bénard L, Saliba Y, Laggerbauer B, Nieswandt B, Lacampagne A, Hajjar RJ, Lompré AM, Engelhardt S. Critical role for stromal interaction molecule 1 in cardiac hypertrophy. Circulation. 2011 Aug 16;124(7):796-805.
49. Braun A, Vogtle T, Varga-Szabo D, Nieswandt B. STIM and Orai in hemostasis 3. and thrombosis. Front Biosci (Landmark Ed). 2011 Jun 1;16:2144-60.
50. Varga-Szabo D, Braun A, Nieswandt B. STIM and Orai in platelet function. Cell Calcium. 2011 Sep;50(3):270-8. doi: 10.1016/j.ceca.2011.04.002.
51. Bender M, Hofmann S, Stegner D, Chalaris A, Bösl M, Braun A, Scheller J, Rose-John S, Nieswandt B. Differentially regulated GPVI ectodomain shedding by multiple platelet-expressed proteinases. Blood. 2010 Oct 28;116(17):3347-55.
52. Gilio K, van Kruchten R, Braun A, Berna-Erro A, Feijge MA, Stegner D, van der Meijden PE, Kuijpers MJ, Varga-Szabo D, Heemskerk JW, Nieswandt B. Roles of platelet STIM1 and Orai1 in glycoprotein VI- and thrombin-dependent procoagulant activity and thrombus formation. J Biol Chem. 2010 Jul 30;285(31):23629-38.
53. Elvers M, Stegner D, Hagedorn I, Kleinschnitz C, Braun A, Kuijpers ME, Boesl M, Chen Q, Heemskerk JW, Stoll G, Frohman MA, Nieswandt B. Impaired alpha(IIb)beta(3) integrin activation and shear-dependent thrombus formation in mice lacking phospholipase D1. Sci Signal. 2010 Jan 5;3(103):ra1.
54. Schuhmann MK, Stegner D, Berna-Erro A, Bittner S, Braun A, Kleinschnitz C, Stoll G, Wiendl H, Meuth SG, Nieswandt B. Stromal interaction molecules 1 and 2 are key regulators of autoreactive T cell activation in murine autoimmune central nervous system inflammation. J Immunol. 2010 Feb 1;184(3):1536-42
55. Berna-Erro A, Braun A, Kraft R, Kleinschnitz C, Schuhmann MK, Stegner D, Wultsch T, Eilers J, Meuth SG, Stoll G, Nieswandt B. STIM2 regulates capacitive Ca2+ entry in neurons and plays a key role in hypoxic neuronal cell death. Sci Signal. 2009 Oct 20;2(93):ra67.
56. Beyersdorf N, Braun A, Vögtle T, Varga-Szabo D, Galdos RR, Kissler S, Kerkau T, Nieswandt B. STIM1-independent T cell development and effector function in vivo. J Immunol. 2009 Mar 15;182(6):3390-7.
57. Böttcher RT, Wiesner S, Braun A, Wimmer R, Berna A, Elad N, Medalia O, Pfeifer A, Aszódi A, Costell M, Fässler R. Profilin 1 is required for abscission during late cytokinesis of chondrocytes. EMBO J. 2009 Apr 22;28(8):1157-69.
58. Braun A, Gessner JE, Varga-Szabo D, Syed SN, Konrad S, Stegner D, Vögtle T, Schmidt RE, Nieswandt B. STIM1 is essential for Fcgamma receptor activation and autoimmune inflammation. Blood. 2009 Jan 29;113(5):1097-104.
59. Nevalainen EM, Skwarek-Maruszewska A, Braun A, Moser M, Lappalainen P. Two biochemically distinct and tissue-specific twinfilin isoforms are generated from the mouse Twf2 gene by alternative promoter usage. Biochem J. 2009 Jan 15;417(2):593-600.
60. Braun A, Varga-Szabo D, Kleinschnitz C, Pleines I, Bender M, Austinat M, Bösl M, Stoll G, Nieswandt B. Orai1 (CRACM1) is the platelet SOC channel and essential for pathological thrombus formation. Blood. 2009 Feb 26;113(9):2056-63.
61. Varga-Szabo D, Braun A, Kleinschnitz C, Bender M, Pleines I, Pham M, Renné T, Stoll G, Nieswandt B. The calcium sensor STIM1 is an essential mediator of arterial thrombosis and ischemic brain infarction. J Exp Med. 2008 Jul 7;205(7):1583-91.
62. Varga-Szabo D, Authi KS, Braun A, Bender M, Ambily A, Hassock SR, Gudermann T, Dietrich A, Nieswandt B. Store-operated Ca(2+) entry in platelets occurs independently of transient receptor potential (TRP) C1. Pflugers Arch. 2008 Nov;457(2):377-87. 18546016.
63. Fritsch A, Loeckermann S, Kern JS, Braun A, Bösl MR, Bley TA, Schumann H, von Elverfeldt D, Paul D, Erlacher M, Berens von Rautenfeld D, Hausser I, Fässler R, Bruckner-Tuderman L. A hypomorphic mouse model of dystrophic epidermolysis bullosa reveals mechanisms of disease and response to fibroblast therapy. J Clin Invest. 2008 May;118(5):1669-79.
64. Suemoto H, Muragaki Y, Nishioka K, Sato M, Ooshima A, Itoh S, Hatamura I, Ozaki M, Braun A, Gustafsson E, Fässler R. Trps1 regulates proliferation and apoptosis of chondrocytes through Stat3 signaling. Dev Biol. 2007 Dec 15;312(2):572-81.
65. Grosse J, Braun A, Varga-Szabo D, Beyersdorf N, Schneider B, Zeitlmann L, Hanke P, Schropp P, Mühlstedt S, Zorn C, Huber M, Schmittwolf C, Jagla W, Yu P, Kerkau T, Schulze H, Nehls M, Nieswandt B. An EF hand mutation in Stim1 causes premature platelet activation and bleeding in mice. J Clin Invest. 2007 Nov;117(11):3540-50.
66. Chu H, Thievessen I, Sixt M, Lämmermann T, Waisman A, Braun A, Noegel AA, Fässler R. gamma-Parvin is dispensable for hematopoiesis, leukocyte trafficking, and T-cell-dependent antibody response. Mol Cell Biol. 2006 Mar;26(5):1817-25.
67. Stanchi F, Bordoy R, Kudlacek O, Braun A, Pfeifer A, Moser M, Fässler R. 4. Consequences of loss of PINCH2 expression in mice. J Cell Sci. 2005 Dec 5. 15;118(Pt 24):5899-910. doi: 10.1242/jcs.02686.
68. Li S, Bordoy R, Stanchi F, Moser M, Braun A, Kudlacek O, Wewer UM, Yurchenco PD, Fässler R. PINCH1 regulates cell-matrix and cell-cell adhesions, cell polarity and cell survival during the peri implantation stage. J Cell Sci. 2005 Jul 1;118(Pt 13):2913-21.
69. Sakai T, Li S, Docheva D, Grashoff C, Sakai K, Kostka G, Braun A, Pfeifer A, Yurchenco PD, Fässler R. Integrin-linked kinase (ILK) is required for polarizing the epiblast, cell adhesion, and controlling actin accumulation. Genes Dev. 2003 Apr 1;17(7):926-40.
70. Braun A, Bordoy R, Stanchi F, Moser M, Kostka G G, Ehler E, Brandau O, Fässler R. PINCH2 is a new five LIM domain protein, homologous to PINCHand localized to focal adhesions. Exp Cell Res. 2003 Apr 1;284(2):239-50. doi: 10.1016/s0014-4827(02)00039-3.
71. Samulowitz U, Kuhn A, Brachtendorf G, Nawroth R, Braun A, Bankfalvi A, Böcker W, Vestweber D. Human endomucin: distribution pattern, expression on high endothelial venules, and decoration with the MECA-79 epitope. Am J Pathol. 2002 May;160(5):1669-81.
72. Braun A, Aszódi A, Hellebrand H, Berna A, Fässler R, Brandau O. Genomic organization of profilin-III and evidence for a transcript expressed exclusively in testis. Gene. 2002 Jan 23;283(1-2):219-25.