Leitung
Dr. Elmina Bach
Krebs Gerinnsel und Entzündung
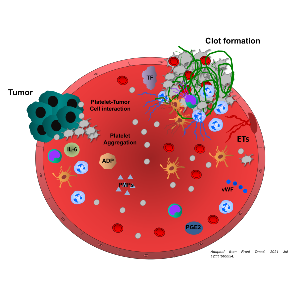
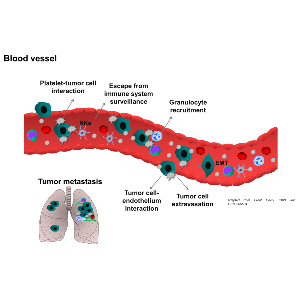
Das Fortschreiten der Krebserkrankung wird durch die dynamische Interaktion zwischen Krebszellen und verschiedenen Komponenten der Umgebung gesteuert. Diese Tumormikroumgebung besteht aus komplexen Geweben, die extrazelluläre Matrix, Wachstumsfaktoren, Zytokine, Chemokine und Adhäsionsrezeptoren sowie viele Zelltypen wie Fibroblasten, Immunzellen, Epithelzellen, Adipozyten, lymphatische und endotheliale Zellen und Blutplättchen enthalten. Es gibt überzeugende Belege dafür, dass die zellulären und molekularen Komponenten der Tumormikroumgebung die Immunabwehr, das Fortschreiten der Krebserkrankung und die Metastasierung entscheidend beeinflussen und an der erworbenen Resistenz von Tumoren gegenüber Therapien beteiligt sind. Die Ausbreitung von Tumorzellen aus primären Organen zu den Metastasen erfolgt durch den Transport von Krebszellen durch den Blut- oder Lymphkreislauf. Die Verbreitung zirkulierender Krebszellen wird auch durch die enge Interaktion mit Blutplättchen und entzündlichen Immunzellen unterstützt, wodurch das Überleben der Tumorzellen und die Bildung metastatischer Nischen gefördert werden. Tumorbedingte Entzündungen und Thrombosen sind Kennzeichen vieler solider Krebsarten, darunter Brust-, Dickdarm-, Eierstock-, Bauchspeicheldrüsen- und Nierenzellkarzinome. Das Eindringen von Immunzellen wie Neutrophilen, Monozyten und Lymphozyten in den Tumor steht in Zusammenhang mit einer schlechten Prognose, einem fortgeschrittenen Tumorstadium und -grad sowie der Metastasierung des Tumors. Darüber hinaus sind eine erhöhte Thrombozytenzahl und eine gerinnungsfördernde Mikroumgebung des Tumors Indikatoren für eine schlechte Prognose und implizieren ein höheres Risiko für thromboembolische Ereignisse und eine Resistenz gegenüber Chemotherapien. Die molekularen Signalwege, die dem Zusammenspiel von Blutplättchen, Krebs und Immunzellen zugrunde liegen, sind jedoch nach wie vor nur unzureichend bekannt, und die Identifizierung der Pathomechanismen könnte zur Entwicklung neuer therapeutischer Ansätze beitragen. Wir sind daran interessiert, die Auswirkungen der Tumormikroumgebung, einschließlich entzündlicher Immunzellen und Blutplättchen, auf das Primärtumorwachstum zu entschlüsseln und die molekularen Mechanismen der Tumorinvasion und -metastasierung zu verstehen.
Wir untersuchen die Regulierungsmechanismen mit einer breiten Palette biologischer Instrumente, darunter genetische und experimentelle Mausmodelle der Krebsentstehung und Tumormetastasierung, klinisch relevante blockierende chemische Inhibitoren und Antikörper sowie modernste 3D-Zellkulturtechniken. Wir erforschen auch zelluläre und biochemische Marker in Gewebe- und Flüssigbiopsien von Krebspatienten und integrieren bioinformatische Analysen und computergestützte Modellierung. Wir haben zahlreiche wissenschaftliche Kooperationen mit nationalen und internationalen Forschungsinstituten aufgebaut (Abteilung für Nephrologie, Medizinische Klinik IV, LMU Klinikum; TU München; Universität Freiburg; Université Côte d'Azur, Nizza; Université de Strasbourg und CRCL Lyon), die Biologen, klinische Forscher und Mediziner zusammenbringen, um komplexe molekulare Mechanismen der Onkogenese und des Krebsfortschritts besser zu verstehen. Unsere Gruppe ist auch an Forschungsaktivitäten mit Industriepartnern (AdvanceCor) beteiligt, um neue pharmakologische Instrumente in Mausmodellen für Krebs zu testen, die auf für die Mikroumgebung des Tumors relevante zelluläre und molekulare Pfade abzielen, einschließlich Blutplättchen und andere zirkulierende Blutzellen.
Leitung der AG Bach
Mitglieder der AG Bach
| Name | Telefon | Raum | Funktion | |
|---|---|---|---|---|
| Han, Chao | Chao.Han@campus.lmu.de | Doktorand | ||
| Min, Nadejda | Nadejda.Min@campus.lmu.de | Doktorantin | ||
| Pinarci, Akif | Akif.Pinarci@campus.lmu.de | +49 89 2180 75730 | Doktorand |
Publikationen
Publikationen auf PubMed.

